
上海交大长三角创新医疗器械注册研究与临床转化系列课程(YMRC)第十一期
8月12日,由转化医学国家重大科技基础设施(上海)创新医疗器械注册研究与临床转化服务中心(NFTM-MRC)主办的上海交通大学长三角创新医疗器械注册研究与临床转化系列课程(YMRC)第11期在线上举行,出席论坛的有上海健康医学院医疗产品管理专业系主任、副教授蒋海洪,NFTM-MRC副主任万克明、许苑晶等。论坛首先由万克明副主任介绍NFTM-MRC,中心由戴尅戎院士担任名誉主任,王金武教授担任中心主任,可提供3D打印医疗器械设计、科研成果转化、注册申报和临床试验等技术服务。

蒋海洪教授带来了"从法规调整看医疗器械审评审批动向"的主题讲课,围绕医疗器械全生命周期介绍国内医疗器械法规体系,重点讲解《医疗器械监督管理条例》、《医疗器械生产管理办法》、《医疗器械经营管理办法》、《医疗器械注册与备案管理办法》、《体外诊断试剂注册与备案管理办法》的历史演变和主要内容。

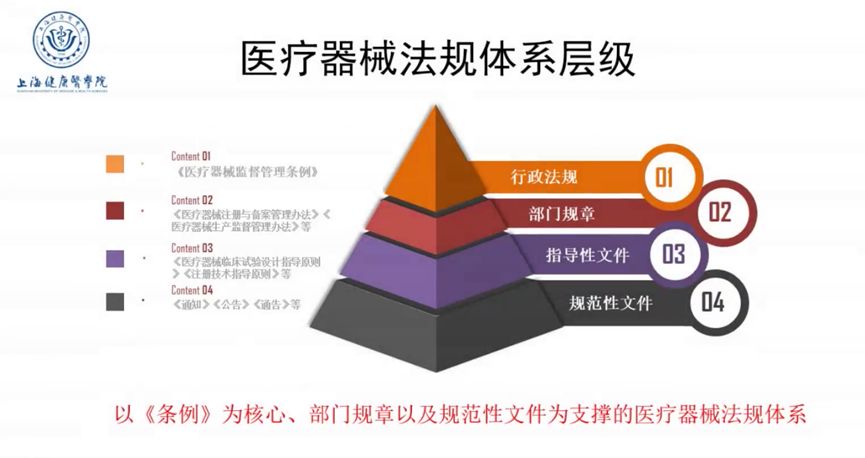
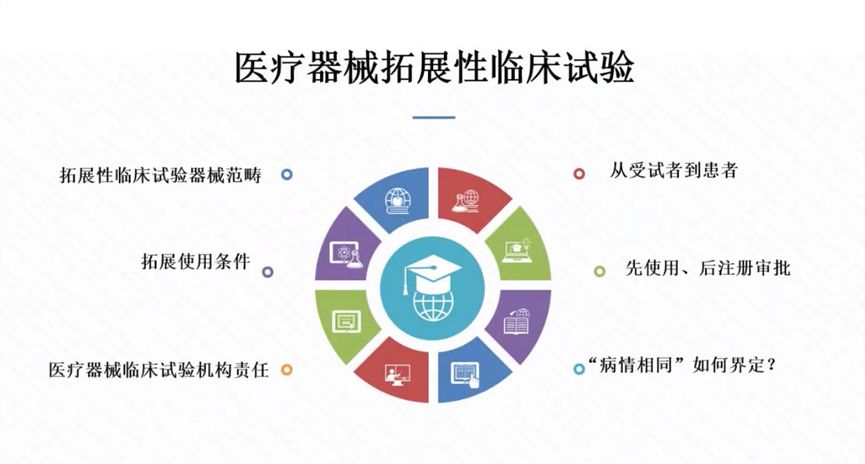
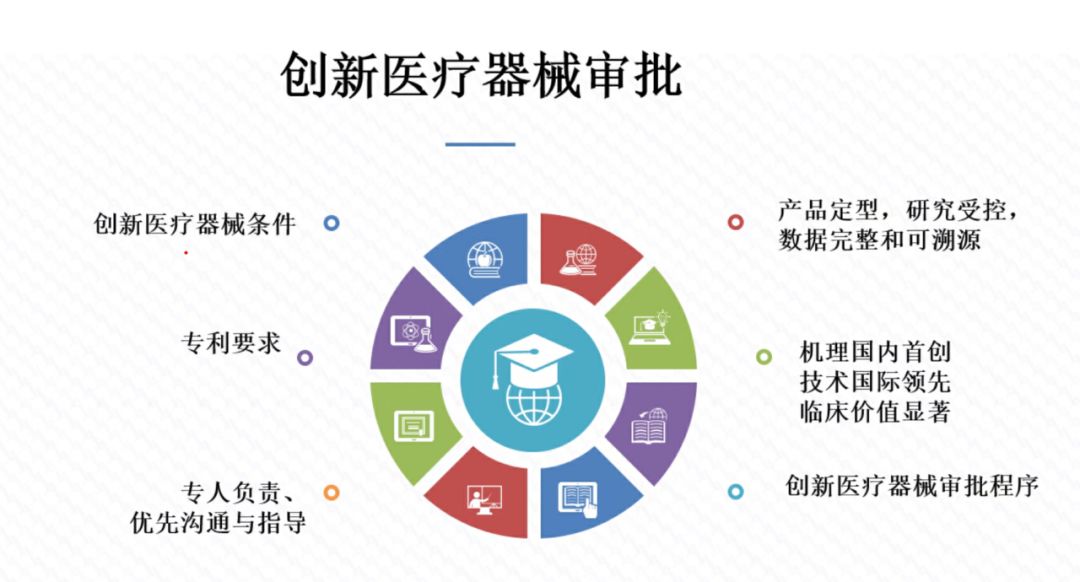
2000年,国务院制定了《医疗器械监督管理条例》,2014年、2017年分别作了全面修订和部分修改。2020年12月21日,国务院第119次常务会议审议通过新修订《医疗器械监督管理条例》,于2021年6月1日起施行。针对新制度对审评审批的新要求,蒋海洪教授强调原“注册人制度”名称已新增“备案人”,在实施过程中应重点关注制度的“主体、目标、定位、手段、内容与比较”六要素,并介绍医疗器械拓展性临床试验、附条件审批、紧急使用授权、创新审批、优先审批,医疗机构体外诊断试剂自研自用、紧急进口少量器械等特殊要求与申请方法。蒋教授提出医疗器械审评审批具有以下的新趋势:1.传统审评审批格局被打破;2.边评价、边使用;3.先使用、后审评、再审批;4.注重满足临床急需、医院特定情形使用无证产品;5.审评方式更为灵活。
最后蒋海洪教授总结了医疗器械审评审批新政产生的影响,作为申报主体的企业具有多种备案、注册方法选择,需要根据产品的特性和上市要求决定合适的路径,如果有特殊需求,比如跨省委托等,则需同监管部门提前沟通。对于研发和医疗机构,作为创新的主体不再局限于专利转让等传统转化方式,可通过委托生产等深度参与成果落地。
医疗器械质量安全一直以来备受高度重视,此次课程致力于培养我国医疗器械产业的优秀法规人才,通过深入讲解医疗器械审评审批制度的改革,为相关从业者在新法规下的医疗器械备案与注册申报授业解惑。

Copyright © 2022 Corporation All Rights Reserved
地址:上海市闵行区剑川路上海交通大学闵行校区 邮编:201203
技术支持:交大课题组