
上海交大长三角创新医疗器械注册研究与临床转化系列课程(YMRC)第八期
7月8日,由转化医学国家重大科技基础设施(上海)创新医疗器械注册研究与临床转化服务中心(NFTM-MRC)主办的上海交通大学长三角创新医疗器械注册研究与临床转化系列课程(YMRC)第8期在线上举行。出席论坛的有上海交通大学医学院附属第九人民医院、NFTM-MRC主任王金武教授,副主任万克明等。论坛由苏州微创再生医学科技有限公司质量与注册部总监白玉龙讲解《脱细胞基质研发质量管理及产品注册申报》。

会议开场由王金武教授致辞,他提出再生医学的迅速发展伴随着相关器械注册难题,脱细胞基质具有良好的内源性组织诱导能力,适合细胞的黏附和生长,被广泛应用于烧烫伤、牙周修复、矫形外科、硬脑膜修复等领域,此次课程致力于讨论此类产品的研发与注册方法。
万克明副主任介绍NFTM-MRC的工作开展情况,中心由戴尅戎院士担任名誉主任,依托高校进行产学研医用相关标准、检测、注册研究服务一体的技术服务,并开展高校试制基地与监管科学的探索,旨在协助科研团队加速医疗器械产业化。

白玉龙总监带来课程《脱细胞基质研发质量管理及产品注册申报》,从脱细胞基质的产品简介、研发质量管理、注册申报三个方面进行讲解。他首先介绍了脱细胞基质医疗器械的定义与来源,包括捐献的人体或动物组织及组织衍生物,其优势在于由天然的组织成分及结构组成,具有良好的生物相容性和悠久的临床使用历史。

针对脱细胞基质等产品的研发,白玉龙总监建议无论是高校、医院,或是工业界的医疗器械研发人员,均应该熟悉相关质量体系法规与标准要求,建立GMP质量规范意识和管理体系。对于实验室质量管理,可以阅读FDA的相关指南,要求实验与生产人员规范详实地书写实验记录本、物料采购和检验记录、研发环境和设备的管理文件等,保证记录输出的可追溯性。
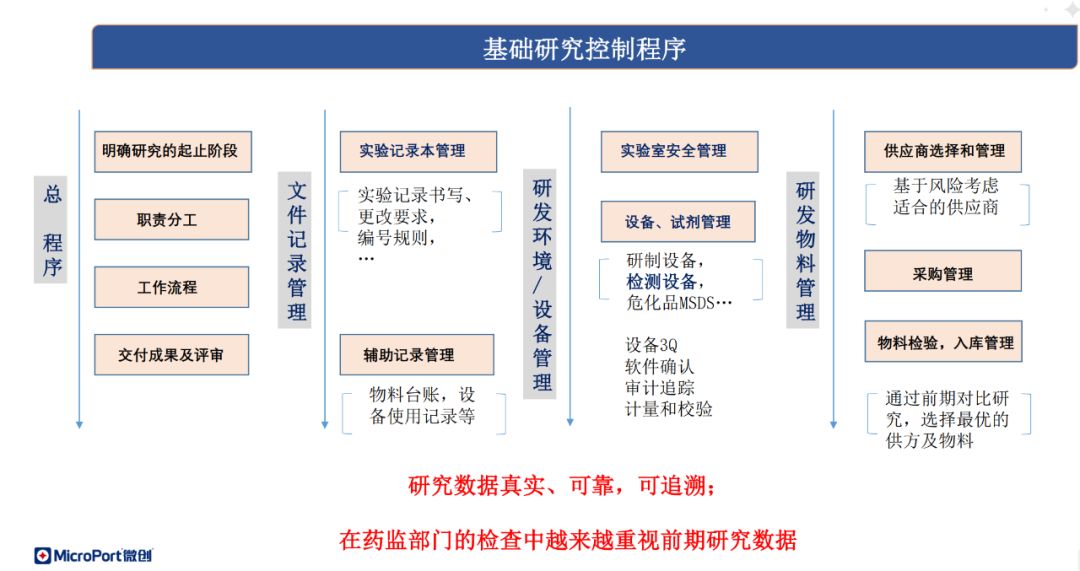
最后,他介绍了注册与法规人员在器械研发到上市后监管全生命周期里的职责划分与重要性,对于脱细胞基质产品,他提出还需注意注册资料里的设计输出应包括原材料供方、原材料、病毒灭活和抗原去除的要求等,而此类产品由于其风险性,一般需要通过临床试验获取临床评价证据。

上海交大创新医械注册转化服务中心将持续提供优质的线上课程,所有线上学员均可申请成为上海交大转化注册中心会员,成为上海交大注册转化Family的成员,免费获得今后学术通知与生物医药产业转化服务的机会!

Copyright © 2022 Corporation All Rights Reserved
地址:上海市闵行区剑川路上海交通大学闵行校区 邮编:201203
技术支持:交大课题组