
上海交大长三角创新医疗器械注册研究与临床转化系列课程(YMRC)第五期
5月26日,由转化医学国家重大科技基础设施(上海)创新医疗器械注册研究与临床转化服务中心、上海交通大学转化医学研究院、上海交通大学涉及人的科技伦理审查委员会主办的上海交通大学长三角创新医疗器械注册研究与临床转化系列课程(YMRC)第五期在线上举行。出席论坛的有上海交通大学涉及人的科技伦理审查委员会主席师咏勇教授、秘书郭舒扬,上海交通大学医学院附属第九人民医院、NFTM-MRC主任王金武教授,上海交通大学医学院附属第九人民医院药物临床试验机构办公室的金剑主任、NFTM-MRC副主任万克明等。论坛由金剑主任讲解《医疗器械和体外诊断试剂临床试验的规范实施和管理》,万克明主持。

论坛首先由王金武主任致辞,他提出国家药监局在去年9月16日发布了《体外诊断试剂临床试验技术指导原则的通告》(2021年第72号)、今年3月30日发布了《医疗器械临床试验质量管理规范》(2022年第28号),要求各省级药品监督管理部门应当加强规范的宣贯培训工作,督促医疗器械临床试验申办者和临床试验机构落实相关要求,提高临床试验质量,确保临床试验过程规范,结果真实、准确、完整和可追溯。王金武主任指出,随着科研的需求,越来越多的科研团队与GCP医生合作开展临床试验设计,高水平的临床科研论文不仅在理论上有所领先、方法先进,而且具有完整、严谨的临床试验设计及科学的统计学方法,作为临床试验报告和评价的基础,临床试验的规范实施和管理尤为重要,此次论坛将围绕《医疗器械和体外诊断试剂临床试验的规范实施和管理》开展讲座与交流。
师咏勇教授致辞表示,上海交通大学科技伦理工作在大家的关注和支持下,今年取得了长足的进展。从科研工作以及与医学临床实践结合的角度,相关应用需求越来越多。师咏勇教授表示,伦理委员会将进一步提高工作流程规范,为更多团队提供伦理审查等服务。
郭舒扬秘书从伦理委员会的发展历程、组织架构、工作机制等方面介绍上海交通大学涉及人的科技伦理审查委员会。在具体的审查方案里,以研究者的角度来讲主要包括了三个阶段,首先是申请阶段,其次是审查阶段,分为快速审查和会议审查两种,依据不同的项目情况来进行不同的流程,最后由委员会来确认伦理审查的结果。2021年委员会审查了240余项,以生物医药、工程技术为主。郭舒扬表示,伦理委员会日后将进一步迭代优化审查流程,进一步提高审查效率,持续保证业务规范。

金剑主任以《医疗器械和体外诊断试剂临床试验的规范实施和管理》为题进行报告,介绍了背景、相关定义、分类管理要求、临床试验的规范实施和管理、医疗器械临床试验检查要点和法律法规。

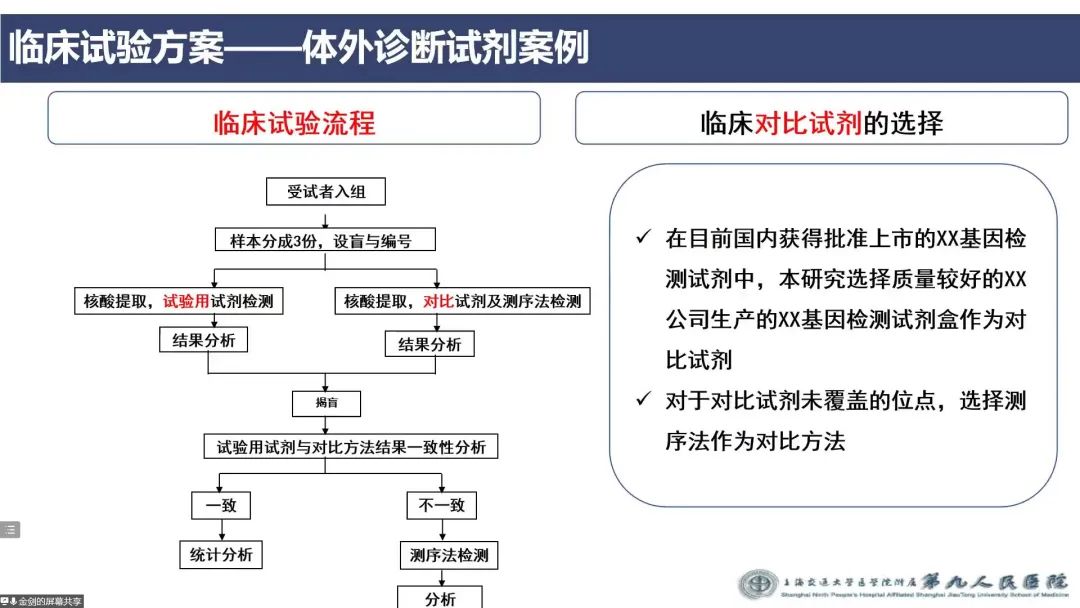
他首先从法规层面系统的从监督管理条例、临床试验质量管理规范、临床试验指导原则介绍了法规的要求。随后以科室手术器械为例,介绍了国内医疗器械的分类管理、申办者和研究者的要求。重点介绍了临床试验方案中的受试对象、盲法考虑、评价指标、样本量估计,并且以某项前瞻性、多中心、随机对照、非劣效临床试验为例重点介绍了样本量估计。临床试验设计的基本类型有平行对照设计、配对设计、交叉设计、单组设计,对于医疗器械试验,大部分为不完整设盲。对于第二类体外诊断试剂产品,总样本数至少为200例,第三类体外诊断试剂产品,总样本数至少为1000例。
金剑主任同时强调试验用医疗器械提供、接收、储存、培训、使用、销毁要求和注意事项;以及临床试验风险控制、文档管理要求和知情同意。伦理委员会对临床试验的重点审查点是知情同意书,知情同意要做到:完全告知,充分理解,自主选择。对于不同类型的受试者,签署知情同意的要求也不同,比如对于无阅读能力的受试者,应该在一位公正见证人的见证下签署知情同意或者按手印。最后,他介绍了医疗器械临床试验检查要点,以注册申请提交的临床试验资料与临床试验机构保存的试验资料不一致为例,重点强调了临床试验法律法规的红线。

Copyright © 2022 Corporation All Rights Reserved
地址:上海市闵行区剑川路上海交通大学闵行校区 邮编:201203
技术支持:交大课题组