
上海交大长三角创新医疗器械注册研究与临床转化系列课程(YMRC)第三期
5月6日,由转化医学国家重大科技基础设施(上海)创新医疗器械注册研究与临床转化服务中心(NFTM-MRC)主办的上海交通大学长三角创新医疗器械注册研究与临床转化系列课程(YMRC)第三期在线上举行。出席课程的有NFTM-MRC主任、上海交通大学医学院附属第九人民医院王金武教授, NFTM-MRC副主任万克明、奥咨达法规事业部法规中心王智总监等。论坛由王智讲解《可穿戴医疗器械的上市路径分享》、万克明主持。

论坛首先由王金武主任致辞,他提出信息化时代改变着生活的方方面面,随着5G技术、人工智能、传感器等技术的迭代发展,可穿戴医疗器械已实现多项技术突破,目前该行业已进入快速发展阶段,在健康监测、远程康复方面也发挥着重要作用。探索更为高效的产品上市路径,也成为相关科研团队及企业关注的焦点,希望此次课程可以向参会者分享该领域前沿转化研究的成果与案例。万克明副主任介绍NFTM-MRC的工作开展情况,中心由戴尅戎院士担任名誉主任,依托高校进行产学研医用相关标准、检测、注册研究服务一体的技术服务,并开展高校试制基地与监管科学的探索,旨在协助科研团队加速医疗器械产业化。
课程主讲人王智是奥咨达法规事业部法规中心总监、奥咨达上海分公司副总经理,专注医疗器械行业15年,曾在有源医疗、移动医疗企业担任项目总监、注册经理、体系主管、软硬件开发工程师等。他具有丰富的有源产品、医疗器械独立软件注册咨询经验,在三类有源器械、医疗器械软件、移动医疗产品、AI辅助诊断等领域,具有丰富的注册咨询经验。此次他结合医疗器械行业的发展趋势,介绍可穿戴医疗器械的上市情况、技术标准、研制难点、临床评价及开发控制等方面的内容,引导与会人员开发符合国家法规及标准的产品,从而加快产品上市。

目前国内已经获证的可穿戴医疗器械包括手表穿戴类、心贴穿戴类、掌上实用类和其他产品,从结构上划分为生理参数传感器、硬件平台与软件应用部分。硬件平台作为传感器的载体,采集心电、血压等生理数据并进行前处理、数字化、分析计算、显示存储、云计算等;软件应用部分作为核心部件则起到了生理信号数据采集和显示、健康管理和干预治疗等功能,后两类用途接近于“数字疗法”。

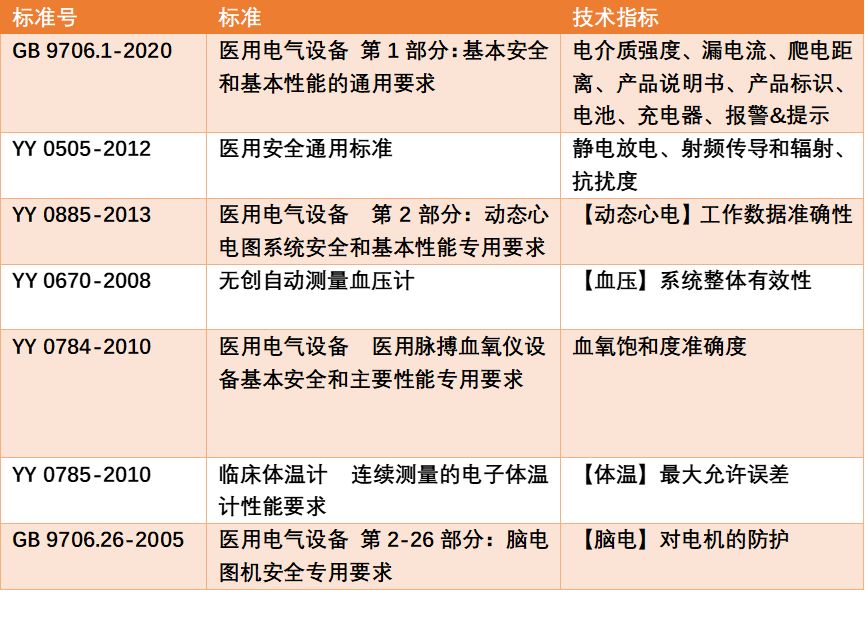
可穿戴医疗器械研制过程中常见的显著难点包括软硬件定型不同步,王智建议产品应根据用户需求和产品特点进行规划,由于现有医疗器械分类目录主要通过临床使用目的进行归类,针对个人健康管理等家庭使用场景的可穿戴医疗器械在注册前,必要时建议先申请分类界定。他以动态心电、血氧检测仪、血压计等为例,讲解硬件的定型需要重点关注国内外技术标准,按标准要求采用相关方法或数据库对技术指标进行验证。
软件定型则需要考虑基本信息、基本特征、临床评价、软件功能和网络安全,确定产品收益、风险和失效对人体造成的危害,通过医疗器械临床评价系列指导原则开展临床试验或同品种比对。此外需要确定软件功能的载体使用的算法并开展软件测试、验证和确认,包括可追溯性分析和人因工程可用性研究,建议参照医疗器械软件注册审查指导原则。对于网络安全部分,则可以参照医疗器械网络安全注册审查指导原则。
对于可穿戴医疗器械的上市难度还包括了临床评价,同品种临床评价重点是获取申报产品临床数据与对比产品临床数据,性能参数不易获取则难以论证等同器械,缺少对比产品临床数据,难以证明产品的安全有效性时,需要收集多个对比产品。在开展临床试验,则需要明确产品的用途,最难的可能是需要大样本量的筛查用途,辅助诊断类的产品相对较易开展。
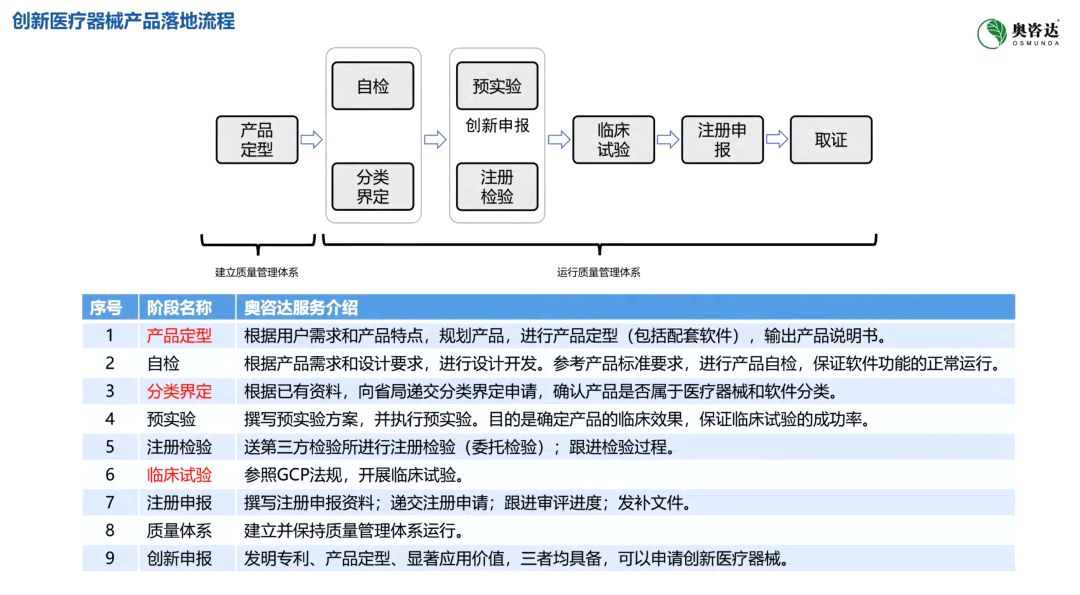
在可穿戴医疗器械的上市过程中,企业还应该掌握法规、指导原则与相关技术标准,质量管理体系的建设是重要抓手。王智建议,对于软硬件部分都需要建立全生命周期控制程序,在前期应与临床专家多次访谈沟通以确定完整的策划需求;通过可追溯分析程序的建立有效地控制研发和验证过程;此外还应重视文件管理和评审过程,该点对产品性能的安全保障非常重要。
此次课程共吸引了数百位与会者收看,授课内容切合可穿戴医疗器械注册上市等实际难题,为相关人员提供了帮助。近期上海交大创新医械注册转化服务中心也将持续提供优质的线上课程,所有线上学员均可加群申请成为上海交大转化注册中心会员,成为上海交大注册转化Family的成员,免费获得今后学术通知与生物医药产业转化服务的机会!

Copyright © 2022 Corporation All Rights Reserved
地址:上海市闵行区剑川路上海交通大学闵行校区 邮编:201203
沪交ICP备20220211 技术支持:戴院士王金武教授科研团队